Liên kết hydro là gì?
Liên kết hydro đề cập đến sự hình thành các liên kết Hydrogen, là một loại lực hấp dẫn liên phân tử đặc biệt phát sinh do tương tác lưỡng cực-lưỡng cực giữa một nguyên tử hydro, được liên kết với một nguyên tử có độ âm điện cao và một nguyên tử có độ âm điện cao khác nằm ở vùng lân cận của nguyên tử hydro.
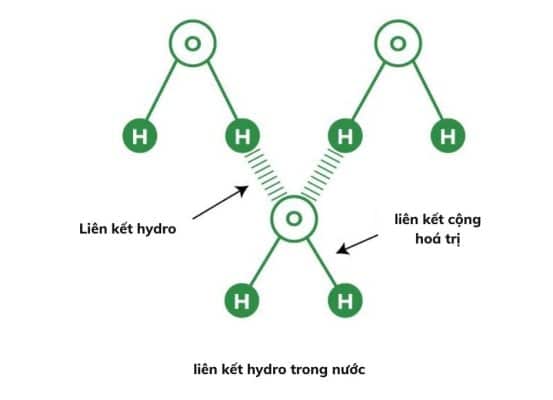
Ví dụ: trong các phân tử nước (H 2 O), hydro được liên kết cộng hóa trị với nguyên tử oxy có độ âm điện lớn hơn. Do đó, liên kết hydro phát sinh trong các phân tử nước do tương tác lưỡng cực-lưỡng cực giữa nguyên tử hydro của một phân tử nước và nguyên tử oxy của một phân tử H 2 O khác.
Liên kết hydro nói chung mạnh hơn lực lưỡng cực-lưỡng cực thông thường và lực phân tán, nhưng yếu hơn liên kết cộng hóa trị và liên kết ion.
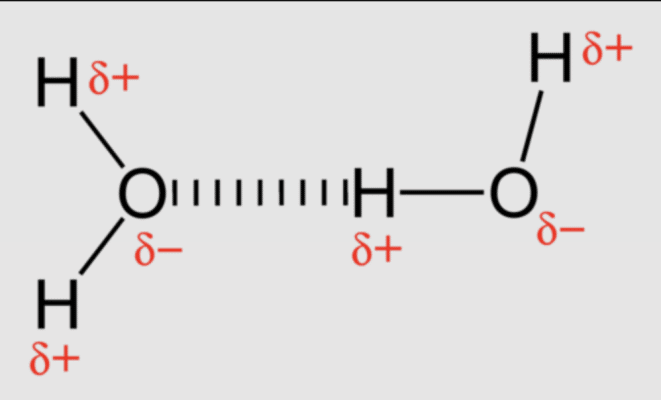
Ở đây, vị trí của cặp electron liên kết trong liên kết OH rất gần với hạt nhân oxy (do sự khác biệt lớn về độ âm điện của oxy và hydro). Do đó, nguyên tử oxy phát triển một phần điện tích âm (-δ) và nguyên tử hydro phát triển một phần điện tích dương (+δ). Bây giờ, liên kết hydro có thể xảy ra do lực hút tĩnh điện giữa nguyên tử hydro của một phân tử nước (có điện tích +δ) và nguyên tử oxy của một phân tử nước khác (có điện tích -δ).
Do đó, điều cần nhớ đó là:
liên kết hydro là một loại lực hấp dẫn liên phân tử rất đặc biệt chỉ phát sinh trong các hợp chất có các nguyên tử hydro liên kết với một nguyên tử có độ âm điện cao. hydro liên kết chủ yếu là mạnh so với lực lưỡng cực-lưỡng cực bình thường và lực phân tán. Tuy nhiên, chúng yếu so với liên kết cộng hóa trị hoặc ion thực sự.
Điều kiện để liên kết hydro xảy ra là gì?
Trong một phân tử, khi một nguyên tử hydro được liên kết với một nguyên tử có độ âm điện cao, nó sẽ hút cặp electron dùng chung nhiều hơn và do đó, đầu này của các phân tử trở nên hơi âm trong khi đầu kia trở nên hơi dương. Đầu âm của một phân tử hút đầu dương của phân tử kia và kết quả là một liên kết yếu được hình thành giữa chúng. Liên kết này được gọi là liên kết hydro.
Là kết quả của liên kết hydro, một nguyên tử hydro liên kết đồng thời hai nguyên tử có độ âm điện , một bằng liên kết cộng hóa trị và nguyên tử kia bằng liên kết hydro. Điều kiện để có liên kết hiđro là:
- Phân tử phải chứa một nguyên tử có độ âm điện cao liên kết với nguyên tử hydro. Độ âm điện càng cao thì sự phân cực của phân tử càng lớn.
- Kích thước của nguyên tử có độ âm điện phải nhỏ. Kích thước càng nhỏ thì lực hút tĩnh điện càng lớn.
Cũng đọc:
Ảnh hưởng của liên kết hydro lên các nguyên tố
Sự kết hợp
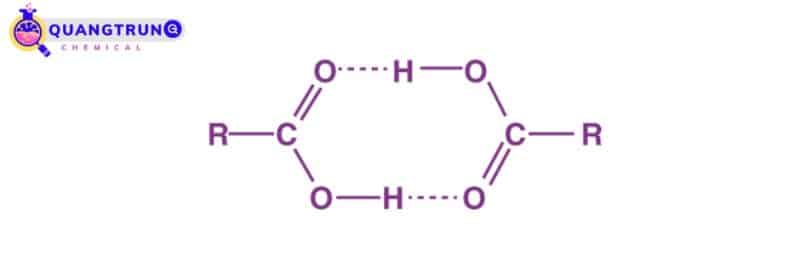
Các phân tử axit cacboxylic tồn tại ở dạng mờ hơn do liên kết hydro. Khối lượng phân tử của các hợp chất như vậy được tìm thấy là gấp đôi so với khối lượng được tính từ công thức đơn giản của chúng.
Phân ly
Trong dung dịch nước, HF phân ly và tạo ra ion diflorua thay vì ion florua. Điều này là do liên kết hydro trong HF. Các phân tử HCl, HBr, HI không tạo thành liên kết hiđro. Điều này giải thích sự không tồn tại của các hợp chất như KHCl 2 , KHBr 2 , KHI 2 .
Tại sao các hợp chất có liên kết hydro có nhiệt độ nóng chảy và sôi cao?
Các hợp chất có liên kết hydro cho thấy nhiệt độ nóng chảy và sôi cao bất thường . Điểm nóng chảy và sôi cao của hợp chất chứa liên kết hydro là do cần thêm năng lượng để phá vỡ các liên kết này.
- Điểm sôi cao bất thường của hydro florua giữa các axit halogen là do sự tồn tại của liên kết hydro.
- H 2 O là chất lỏng trong khi H 2 S, H 2 Se và H 2 Te đều là chất khí ở nhiệt độ thường. Trong nước, liên kết hydro gây ra các liên kết trong phân tử nước dẫn đến nhiệt độ sôi của nước cao hơn nhiệt độ sôi của các hợp chất khác.
- Amoniac có nhiệt độ sôi cao hơn PH 3 vì có liên kết hidro trong NH 3 nhưng không có trong PH 3 .
- Ethanol có nhiệt độ sôi cao hơn dietyl ete vì có liên kết hydro trong etanol.
Ví dụ về liên kết hydro
Liên kết hydro trong hydro florua
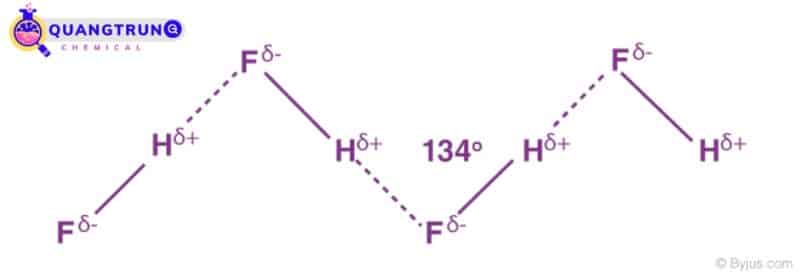
Flo có giá trị độ âm điện cao nhất tạo thành liên kết hydro mạnh nhất.
Liên kết hydro trong nước
Một phân tử nước chứa một nguyên tử oxy có độ âm điện cao liên kết với nguyên tử hydro . Nguyên tử oxy thu hút cặp electron dùng chung nhiều hơn và đầu này của phân tử trở nên âm trong khi các nguyên tử hydro trở nên dương.
Liên kết hydro trong amoniac
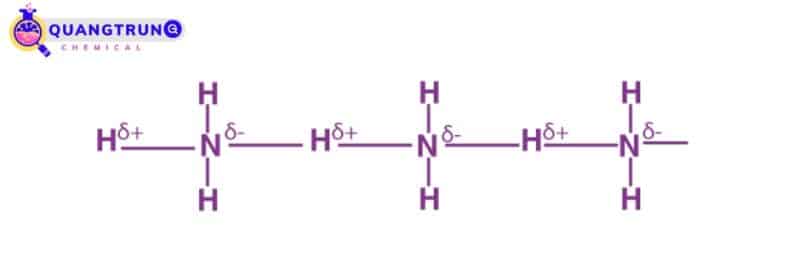
Nó chứa nitơ nguyên tử có độ âm điện cao liên kết với các nguyên tử hydro.
Liên kết hydro trong rượu và axit cacboxylic
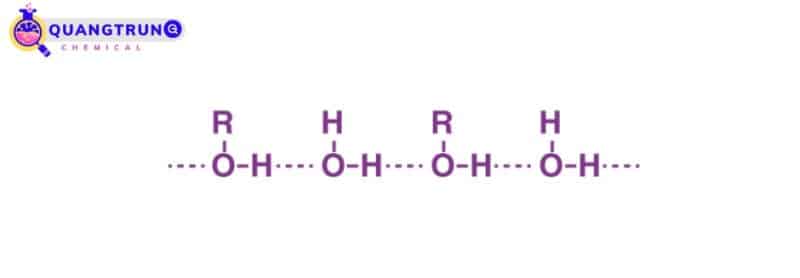
Rượu là một loại phân tử hữu cơ có chứa nhóm -OH. Thông thường, nếu bất kỳ phân tử nào chứa nguyên tử hydro được liên kết trực tiếp với oxy hoặc nitơ, thì liên kết hydro dễ dàng được hình thành.
Liên kết hydro trong polyme
Liên kết hydro là một yếu tố quan trọng trong việc xác định cấu trúc và tính chất 3D mà protein tổng hợp và protein tự nhiên có được. Liên kết hydro cũng đóng một vai trò quan trọng trong việc xác định cấu trúc của cellulose cũng như các polyme dẫn xuất như bông hoặc lanh.
Độ bền của liên kết Hydro
Liên kết hydro là liên kết yếu. Độ bền của liên kết hidro nằm ở giữa lực van der Waals yếu và liên kết cộng hóa trị mạnh.
Năng lượng phân ly của liên kết hydro phụ thuộc vào lực hút của cặp electron dùng chung và do đó phụ thuộc vào độ âm điện của nguyên tử.
Tính chất của liên kết hydro
- Độ hòa tan: Các rượu bậc thấp hòa tan trong nước do liên kết hydro có thể diễn ra giữa phân tử nước và rượu.
- Tính dễ bay hơi: Vì các hợp chất liên quan đến liên kết hydro giữa các phân tử khác nhau có nhiệt độ sôi cao hơn nên chúng ít bay hơi hơn.
- Độ nhớt và sức căng bề mặt: Các chất có chứa liên kết hiđro thì tồn tại dưới dạng phân tử liên kết. Vì vậy, dòng chảy của họ trở nên tương đối khó khăn. Chúng có độ nhớt cao hơn và sức căng bề mặt cao.
- Mật độ của nước đá thấp hơn nước: Trong trường hợp nước đá rắn, liên kết hydro tạo ra cấu trúc giống như cái lồng của các phân tử nước. Trên thực tế, mỗi phân tử nước được liên kết tứ diện với bốn phân tử nước. Các phân tử không được đóng gói chặt chẽ như ở trạng thái lỏng. Khi băng tan, trường hợp này giống như cấu trúc sụp đổ và các phân tử đến gần nhau hơn. Như vậy đối với cùng một khối lượng nước, thể tích giảm và mật độ tăng. Do đó, băng có tỷ trọng thấp hơn nước ở 273 K. Đó là lý do tại sao băng nổi .
Những bài viết liên quan
Các loại liên kết hydro
Có hai loại liên kết H, và nó được phân loại như sau:
- Liên kết hydro liên phân tử
- Liên kết hydro nội phân tử
Liên kết hydro liên phân tử
Khi liên kết hydro diễn ra giữa các phân tử khác nhau của cùng một hợp chất hoặc khác nhau, nó được gọi là liên kết hydro liên phân tử.
Ví dụ – liên kết hidro trong nước, rượu, amoniac , v.v.
Liên kết hydro nội phân tử
Liên kết hiđro diễn ra trong chính phân tử gọi là liên kết hiđro nội phân tử.
Nó diễn ra trong các hợp chất chứa hai nhóm sao cho một nhóm chứa nguyên tử hydro liên kết với nguyên tử có độ âm điện và nhóm còn lại chứa nguyên tử có độ âm điện cao liên kết với nguyên tử có độ âm điện nhỏ hơn của nhóm kia.
Liên kết được hình thành giữa nguyên tử hiđro của nhóm này với nguyên tử có độ âm điện lớn hơn của nhóm kia
Vấn đề: Cho biết phân tử nào sau đây có khả năng tạo liên kết hiđro với các phân tử khác.
Liên kết hydro đối xứng
Đây là một loại liên kết hydro đặc biệt trong đó proton thường được đặt ở giữa hai nguyên tử giống hệt nhau. Độ bền của liên kết giữa mỗi nguyên tử bằng nhau. Liên kết hidro đối xứng là một loại liên kết ba tâm bốn electron. Liên kết này cũng mạnh hơn nhiều so với liên kết hidro “bình thường” và độ bền của nó gần giống với liên kết cộng hóa trị.
Liên kết kim loại là gì?
Kim loại được đặc trưng bởi độ sáng, bóng, tính dẫn điện và nhiệt cao , dễ uốn, dẻo và độ bền kéo cao. Một tinh thể kim loại bao gồm một số lượng rất lớn các nguyên tử được sắp xếp theo một mô hình đều đặn.
Các mô hình khác nhau đã được đề xuất để giải thích bản chất của liên kết kim loại. Hai mô-đun quan trọng nhất như sau.
Mô hình biển điện tử
Trong mô hình này, một kim loại được coi là bao gồm một mạng ion dương (hoặc hạt nhân) được ngâm trong một biển các electron hóa trị di động, di chuyển tự do trong ranh giới của tinh thể. Một hạt nhân dương bao gồm hạt nhân của nguyên tử cùng với lõi của nó trên một hạt nhân, do đó, có độ lớn bằng tổng điện tích hóa trị trên mỗi nguyên tử.
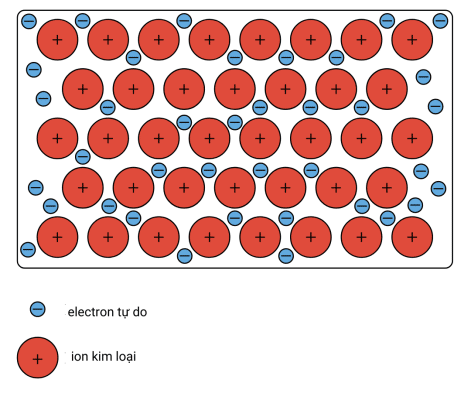
Các electron tự do che chắn các lõi ion tích điện dương khỏi lực đẩy tĩnh điện lẫn nhau mà nếu không chúng sẽ tác động lên nhau. Theo một cách nào đó, các electron tự do này đóng vai trò là “chất keo” để giữ các lõi ion lại với nhau.
Lực giữ các nguyên tử lại với nhau trong kim loại là kết quả của lực hút giữa các ion dương và các electron tự do di động xung quanh được gọi là liên kết kim loại.
Thông qua điện tử, cơ học lượng tử có trước biển nó vẫn giải thích thỏa đáng một số tính chất nhất định của kim loại. Ví dụ, tính dẫn điện và dẫn nhiệt của kim loại có thể được giải thích bằng sự có mặt của các electron di động trong kim loại.
Khi áp dụng một trường điện tử, các điện tử di động này dẫn điện khắp các kim loại từ đầu này sang đầu kia. Tương tự, nếu một phần của kim loại được nung nóng, các electron di động trong phần kim loại đó sẽ thu được một lượng lớn động năng . Tự do và di động, các electron này di chuyển nhanh chóng trong kim loại và dẫn nhiệt đến phần khác của kim loại.
nguồn: bài viết tham khảo nguồn từ wikipedia về liên kết hydro



