Loại liên kết hóa học chính thứ ba là liên kết kim loại. Trong khi liên kết ion nối kim loại với phi kim và liên kết cộng hóa trị nối các phi kim với nhau, thì liên kết kim loại nối phần lớn các nguyên tử kim loại.
Liên kết kim loại
Liên kết kim loại là lực hút tĩnh điện mạnh tồn tại giữa các cation kim loại tích điện dương và các electron tự do.
Liên kết kim loại là một loại liên kết hóa học và chịu trách nhiệm về một số tính chất đặc trưng của kim loại như độ sáng bóng, tính dẻo và tính dẫn nhiệt và điện của chúng.
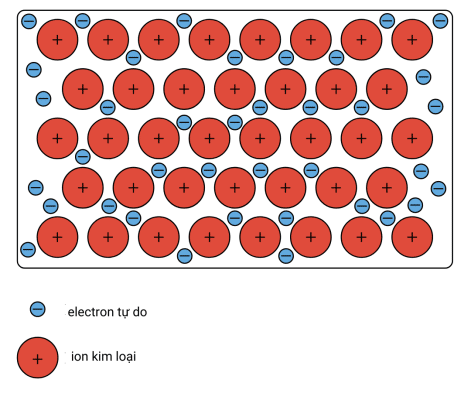
Kim loại được giữ với nhau bằng lực hút mạnh giữa các hạt nhân mang điện tích dương và các electron tự do mang điện tích âm (Hình 1.1). Điều này đôi khi được mô tả là “một dãy các ion dương trong một biển điện tử”.
Ví dụ 1: Ngay cả một kim loại mềm như natri (điểm nóng chảy 97,8°C) cũng nóng chảy ở nhiệt độ cao hơn đáng kể so với nguyên tố (neon) đứng trước nó trong Bảng tuần hoàn.
Không giống như các hợp chất ion, kim loại thường dễ uốn hơn là giòn, cho thấy rằng chúng không tạo thành cấu trúc mạng tinh thể cứng nhắc của các ion tích điện trái dấu. Tuy nhiên, các kim loại cũng không tạo thành các phân tử liên kết như các hợp chất cộng hóa trị.
Ví dụ 2: Xác định lực liên kết chiếm ưu thế trong mạng kim loại khổng lồ
Trong liên kết kim loại, hình thức thu hút chủ yếu giữa mạng các ion dương và biển các electron tự do là gì?
- hấp dẫn
- Hạt nhân
- từ tính
- tĩnh điện
- cộng hóa trị
Câu trả lời
Liên kết kim loại có thể được định nghĩa là lực hút tĩnh điện tồn tại giữa các cation kim loại cố định và các electron di chuyển tự do. Các cation có điện tích dương và chúng bị thu hút bởi các electron di chuyển tự do tích điện âm xung quanh.
Lực hút tĩnh điện giữa các hạt tích điện trái dấu là dạng lực hút chiếm ưu thế trong cấu trúc mạng tinh thể kim loại khổng lồ. Vì vậy lựa chọn chính xác ở đây là D. Lực hút tĩnh điện
Độ bền của liên kết kim loại
Các yếu tố ảnh hưởng đến độ bền của liên kết kim loại bao gồm:
- Tổng số electron tự do.
- Độ lớn của điện tích dương được giữ bởi cation kim loại.
- Bán kính ion của cation
Liên kết kim loại không bị phá vỡ khi nung kim loại ở trạng thái nóng chảy. Thay vào đó, các liên kết này bị yếu đi, khiến cho dãy ion kim loại có trật tự mất đi cấu trúc cứng chắc và xác định của chúng. Và biến chúng trở thành chất lỏng. Tuy nhiên, các liên kết này chỉ bị phá vỡ hoàn toàn khi kim loại được nung nóng đến nhiệt độ sôi.
Mô hình biển điện tử
Một mô hình về “biển điện tử electron tự do” là cần thiết để giải thích các tính chất của các chất kim loại.
Vào những năm 1900, Paul Drüde đã đưa ra lý thuyết liên kết kim loại “biển điện tử” bằng cách mô hình hóa các kim loại dưới dạng hỗn hợp các lõi nguyên tử (lõi nguyên tử = hạt nhân dương + lớp vỏ bên trong của các điện tử) và các electron hóa trị.
Ví dụ liên kết kim loại trong Natri
Lấy kim loại natri làm ví dụ. Natri có cấu trúc điện tử 1s22s22p63s1. Khi các nguyên tử natri kết hợp với nhau, electron trong quỹ đạo nguyên tử 3s của một nguyên tử natri có thể chia sẻ không gian với electron tương ứng trên một nguyên tử lân cận để tạo thành liên kết – theo cách tương tự như cách hình thành liên kết cộng hóa trị.
Tuy nhiên, sự khác biệt là mỗi nguyên tử natri được chạm vào bởi tám nguyên tử natri khác – và sự chia sẻ xảy ra giữa nguyên tử trung tâm và các quỹ đạo 3s trên tất cả tám nguyên tử khác. Mỗi cái trong số tám nguyên tử này lần lượt được tiếp xúc với tám nguyên tử natri, đến lượt tám nguyên tử này tiếp xúc với tám nguyên tử – và cứ tiếp tục như vậy, cho đến khi bạn lấy hết tất cả các nguyên tử trong cục natri đó.
Tất cả các electron 3s trên tất cả các nguyên tử Natri được chia sẻ trong các liên kết không định hướng kéo dài trên toàn bộ mảnh kim loại. Các electron tự do có thể di chuyển tự do bên trong khối kim loại, và do đó, mỗi electron trở nên tách ra khỏi nguyên tử mẹ của nó và trở thành các electron tự do.
Điều quan trọng cần nhận ra ở đây là số lượng các electron tự do hầu như sẽ luôn bằng chính xác số lượng electron hóa trị trong một nguyên tố kim loại nguyên chất.
Liên kết kim loại mạnh
Một liên kết kim loại mạnh sẽ là kết quả của nhiều electron tự do, làm cho điện tích hạt nhân hiệu dụng trên các electron trên cation tăng lên, thực tế là làm cho kích thước của cation nhỏ hơn.
Liên kết kim loại bền và cần nhiều năng lượng để phá vỡ, do đó kim loại có nhiệt độ nóng chảy và nhiệt độ sôi cao.
Các tính chất của kim loại
Liên kết kim loại mang lại cho kim loại có một số phẩm chất độc đáo, khiến chúng trở nên hữu dụng với các mục đích sử dụng và thương mại của con người. Chẳng hạn như:
- Khả năng dẫn điện
- Tính dẫn nhiệt
- Năng lượng ion hóa thấp
- Độ âm điện thấp (vì vậy chúng sẽ dễ dàng nhường electron để tạo thành cation).
- Điểm nóng chảy và điểm sôi cao
Các đặc tính vật lý của chúng bao gồm:
- Tính ánh kim
- Tính dẻo và dễ biến dạng (Kim loại có cấu trúc tinh thể nhưng dễ bị biến dạng).
1. Tính dẫn điện
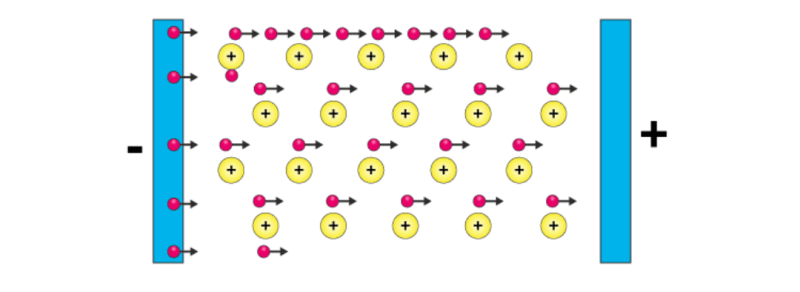
Vì các electron trong liên kết kim loại là tự do và không bị hạn chế trong biển electron, cho nên nếu các electron từ nguồn bên ngoài được đẩy vào một đầu dây kim loại (Hình 1.3), thì các electron sẽ di chuyển qua dây và đi ra ở đầu kia với cùng tốc độ. Vì tính dẫn điện là sự chuyển động của điện tích qua vật liệu, nên kim loại sẽ có thể dẫn điện hiệu quả.
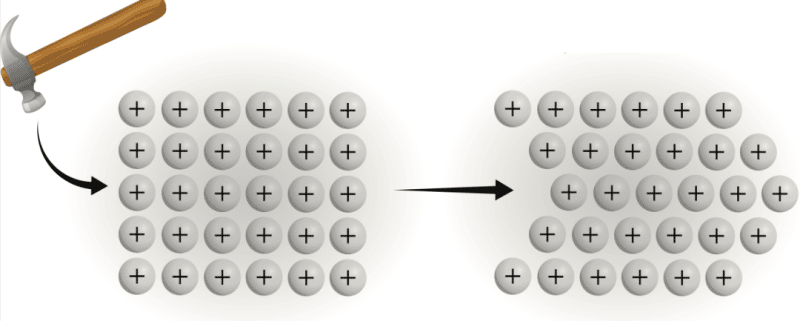
Tính dẻo và tính biến dạng
Mô hình biển điện tử của kim loại không chỉ giải thích các tính chất điện của chúng mà còn cả tính dẻo và tính dẻo của chúng. Biển điện tử bao quanh các proton hoạt động giống như một tấm đệm, và do đó, chẳng hạn như khi kim loại bị đập vào, thành phần tổng thể của cấu trúc kim loại không bị tổn hại hoặc thay đổi.
Các proton có thể được sắp xếp lại nhưng biển electron có thể điều chỉnh để hình thành các proton mới và giữ cho kim loại nguyên vẹn. Khi một lớp ion trong biển điện tử di chuyển dọc theo một khoảng không đối với lớp bên dưới nó, cấu trúc tinh thể không bị đứt gãy (giống như tinh thể ion) mà chỉ bị biến dạng (Hình 1.3).
Điểm nóng chảy và điểm sôi cao
Kim loại có xu hướng có điểm nóng chảy và điểm sôi cao cho thấy liên kết hoá học mạnh giữa các nguyên tử.
Điều này được giải thích bằng khả năng chuyển động của các electron tự do xung quanh chất rắn. Khi chúng di chuyển, chúng truyền nhiệt (nghĩa là động năng) qua vật liệu một cách hiệu quả.
Tính ánh kim
Các electron tự do có thể hấp thụ các photon ánh sáng trong “biển”, vì vậy kim loại trông có vẻ mờ đục. Tuy nhiên, các electron trên bề mặt có thể phản xạ lại ánh sáng ở cùng tần số mà ánh sáng chiếu vào bề mặt, do đó kim loại có vẻ sáng bóng.
Tài liệu tham khảo từ wikipedia bài viết liên kết kim loại
Bài viết tiếp theo: #4 Liên kết hoá học: Quy tắc bát tử và quy tắc octet là gì



