Quy tắc bát tử là gì?
Quy tắc bát tử là một giả thuyết khoa học cực kỳ đơn giản có thể được sử dụng để giải thích các liên kết hoá học và sự hình thành các hợp chất ion và cộng hóa trị.
Nó nói rằng các nguyên tử có xu hướng ổn định hơn nếu chúng có tám electron hóa trị và cấu hình electron giống như một nguyên tử khí hiếm.
Hình dưới đây cho thấy cấu hình electron của ba nguyên tử khí hiếm làm cơ sở cho quy tắc bát tử. Quy tắc bát tử dự đoán rằng các nguyên tử thường phản ứng sao cho chúng có cấu hình electron khớp với một trong các nguyên tử khí hiếm.
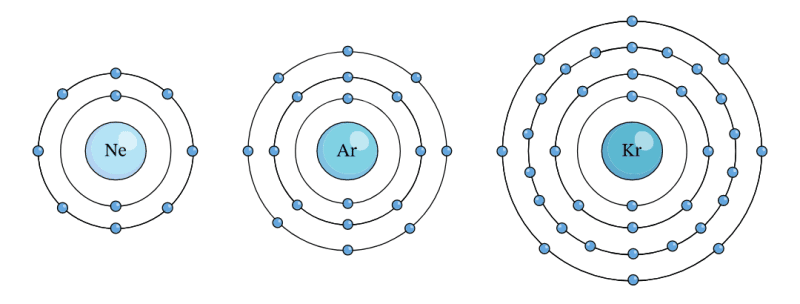
Quy tắc bát tử và quy tắc Octet
Quy tắc bát tử hay còn gọi là quy tắc Octet xuất phát từ giả thuyết Octet nói rằng: Các nguyên tử có xu hướng chuyển hoặc chia sẻ các electron vì điều này giúp chúng có được tám electron hóa trị và cấu hình electron giống như một nguyên tử khí hiếm.
Quy tắc bát tử chỉ áp dụng cho các phần tử nhóm chính.
Các phân tử của halogen, oxy, nitơ và carbon được biết là tuân theo quy tắc bát tử. Nói chung, các nguyên tố tuân theo quy tắc này bao gồm các nguyên tố khối s và các nguyên tố khối p (ngoại trừ hydro, heli và liti).
Quy tắc bát tử có thể được quan sát trong liên kết giữa natri kim loại với clo phi kim. Phản ứng tỏa nhiệt cao và tạo ra sản phẩm natri clorua có độ ổn định cao.
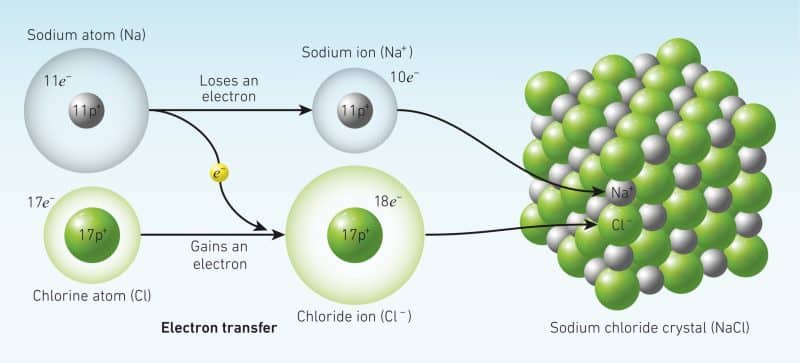
Natri là nguyên tố nhóm I và nó có một electron hóa trị duy nhất. Nó có thể đạt được cấu hình electron giống như nguyên tử neon một cách hiệu quả nếu nó mất đi một electron hóa trị. Nó có thể kết thúc một cách hiệu quả với cấu hình electron giống như một nguyên tử khí hiếm nếu electron hóa trị đơn của nó được chuyển sang một nguyên tử phi kim.
Clo là một nguyên tố nhóm 17 và nó có bảy electron hóa trị trong lớp vỏ hóa trị của nó và có thể đạt được cấu hình octet bằng cách nhận thêm một electron từ một nguyên tử kim loại.
Các nguyên tử natri và clo cuối cùng có cùng cấu hình electron với nguyên tử khí hiếm nếu chúng phản ứng với nhau. Các nguyên tử kim loại Natri chuyển thành các ion tích điện dương khi chúng mất đi các electron. Và các nguyên tử Clo chuyển thành các ion tích điện âm khi chúng nhận được các electron này.
Các ion natri và clorua sản phẩm có cấu hình electron ổn định vì cả hai đều có tám electron hóa trị và cấu hình electron giống như một nguyên tử khí hiếm. Điều này được thể hiện trong Hình 1.1 Liên kết ion NaCl (Muối).
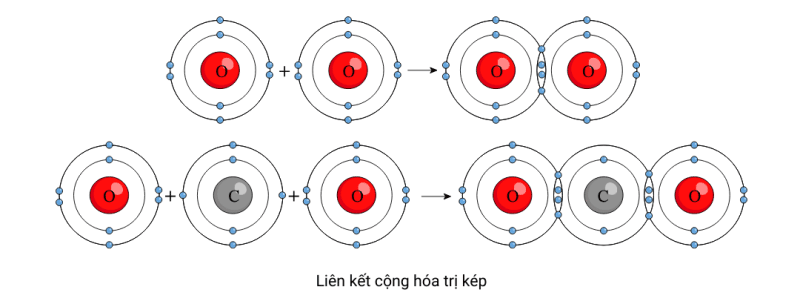
Liên kết cộng hoá trị kép
Hình tiếp theo cho thấy hai loại hợp chất cộng hóa trị khác nhau có thể được hình thành từ các nguyên tử oxy như thế nào. Nó cho thấy làm thế nào các nguyên tử oxy có thể kết hợp với nhau và tạo thành một phân tử oxy. Nó cũng cho thấy làm thế nào hai nguyên tử oxy có thể kết hợp với một nguyên tử carbon và tạo thành một phân tử carbon dioxide.
Các nguyên tử oxy chuyển từ có sáu electron hóa trị sang có tám electron hóa trị khi chúng liên kết với nhau hoặc khi mỗi hai nguyên tử oxy liên kết với một nguyên tử carbon. Bạn sẽ nhận thấy ở đây rằng các nguyên tử oxy chia sẻ hai electron hóa trị khi chúng tạo ra phân tử oxy hai nguyên tử hoặc phân tử carbon dioxide ba nguyên tử.
Hai cặp electron dùng chung thường được gọi là liên kết cộng hóa trị kép (Xem ngay: Liên kết cộng hóa trị). Tương tự, mỗi phân tử carbon dioxide chứa hai nguyên tử oxy được liên kết với một nguyên tử carbon bằng hai liên kết cộng hóa trị kép.
Các electron dùng chung đáp ứng các yêu cầu về hóa trị của cả hai nguyên tử liên kết. Do đó, có thể lưu ý rằng cả nguyên tử oxy và nguyên tử carbon đều có cấu hình octet trong phân tử CO 2 .
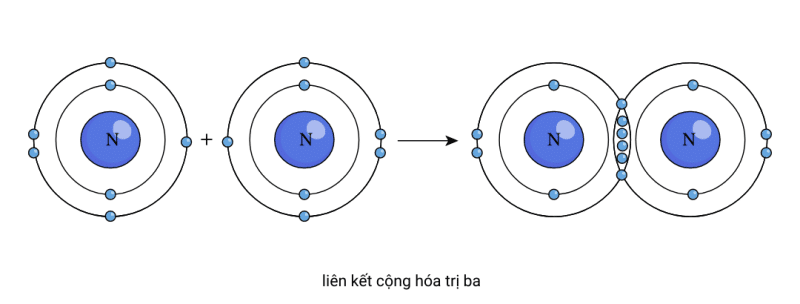
Liên kết cộng hóa trị ba
Một số nguyên tử có xu hướng chia sẻ nhiều hơn hai electron hóa trị vì chúng có năm electron hóa trị hoặc ít hơn. Nitơ là một nguyên tử phi kim loại nhóm 15 và nó có năm electron hóa trị. Nó thực sự có thể có tám electron hóa trị và cấu hình electron giống như nguyên tử neon nếu nó chia sẻ ba electron hóa trị và tạo ra cái gọi là liên kết cộng hóa trị ba.
Ở trường hợp của Nitơ (N2) cho thấy cách hai nguyên tử nitơ có thể kết hợp với nhau và tạo ra một phân tử nitơ hai nguyên tử. Phân tử được tạo thành từ hai nguyên tử mà mỗi nguyên tử có cùng cấu hình electron với nguyên tử neon. Cả hai đều có tám electron hóa trị vì mỗi chúng đóng góp ba electron hóa trị cho liên kết cộng hóa trị ba nitơ-nitơ (N2).
Liên kết cộng hóa trị đơn
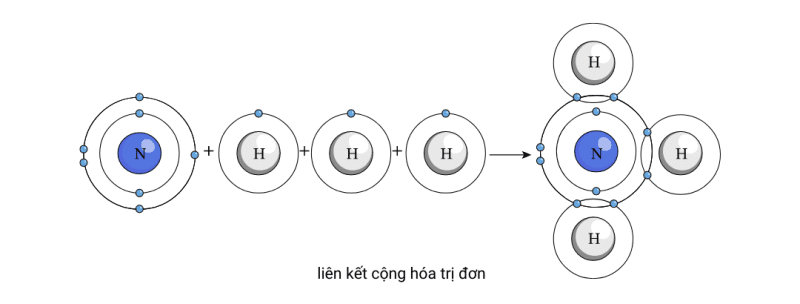
Tương tự, nitơ có thể đạt được cấu hình electron giống như neon nếu nó tạo ra nhiều liên kết cộng hóa trị đơn với các nguyên tử khác. Theo quy tắc Octet, Nitơ có thể thu được ba electron hóa trị một cách hiệu quả nếu nó tạo ra ba liên kết cộng hóa trị đơn với các nguyên tử hydro liền kề.
Hình dưới đây cho thấy rõ về việc quy tắc bát tử về làm thế nào một nguyên tử nitơ đơn lẻ có thể nhận được tám electron hóa trị một cách hiệu quả nếu nó tạo ra một phân tử amoniac. Chúng ta có thể nói rằng một phân tử amoniac chứa một nguyên tử nitơ được liên kết với ba nguyên tử hydro thông qua ba liên kết cộng hóa trị đơn.
Ngoại lệ đối với Quy tắc Octet
Không phải tất cả các nguyên tố và hợp chất đều tuân theo quy tắc bát tử. Một số ngoại lệ đối với quy tắc này được liệt kê dưới đây.
- Một ion, nguyên tử hoặc một phân tử chứa một electron hóa trị chưa ghép cặp được gọi là gốc tự do . Những loài này không tuân theo quy tắc bát tử. Tuy nhiên, chúng rất không ổn định và có xu hướng giảm dần một cách tự nhiên.
- Vì lớp vỏ đầu tiên chỉ có thể chứa hai electron nên các nguyên tố như liti, heli và hydro tuân theo quy tắc song ca thay vì quy tắc bát tử. Ví dụ, liti có thể mất một electron để có cấu hình ổn định trong đó lớp vỏ hóa trị chứa hai electron.
- Do sự hiện diện của quỹ đạo d, các phần tử chuyển tiếp không tuân theo quy tắc bát tử. Vỏ hóa trị của các nguyên tử này có thể chứa 18 electron.
- Các hợp chất thơm liên quan đến sự định vị của các điện tử pi. Các electron này tuân theo quy tắc Huckel
Có thể lưu ý rằng một số phân tử thiếu điện tử như boran và cacboran tuân theo các quy tắc của Wade để có được sự ổn định. Các phân tử này có liên kết 3c-2e (ba liên kết ở giữa) trong đó hai electron được chia sẻ bởi ba nguyên tử.



