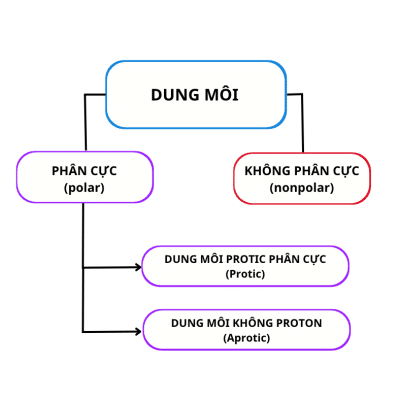
Dung môi được phân loại thành hai loại: dung môi phân cực và không phân cực. Dung môi phân cực được chia thành dung môi protic và aprotic.
Chính xác, sự khác biệt giữa dung môi protic và aprotic có thể được viết là:
Dung môi protic chứa ít nhất một nguyên tử hydro liên kết trực tiếp với nguyên tử có độ âm điện (như F, N, O) và do đó, có thể tạo liên kết hydro. Trong khi đó, các dung môi aprotic (dung môi không proton) không chứa bất kỳ nguyên tử hydro nào liên kết trực tiếp với các nguyên tử có độ âm điện cao và do đó không có khả năng hình thành liên kết hydro.
Sự khác biệt giữa dung môi protic và aprotic
| Dung môi protic | Dung môi aprotic |
| Dung môi protic có ít nhất một nguyên tử hydro liên kết trực tiếp với nguyên tử có độ âm điện (NH, OH, v.v.) | Dung môi tạp chất có thể có các nguyên tử hydro ở đâu đó trong cấu trúc của chúng, nhưng không có nguyên tử hydro nào được kết nối trực tiếp với nguyên tử có độ âm điện |
| Chúng có khả năng tạo liên kết hydro | Chúng không thể tạo liên kết hydro |
| Dung môi protic có tính axit | Dung môi tạp khuẩn không có tính axit |
| Chúng có hằng số điện môi cao | Chúng có hằng số điện môi trung bình và thấp |
| Dung môi protic phân cực rất giàu liên kết OH và NH | Chúng thiếu liên kết OH và NH |
| Chúng được ưu tiên sử dụng để hòa tan muối | Dung môi tạp chất cũng có thể hòa tan muối. Tuy nhiên, khả năng hòa tan muối của chúng phụ thuộc chủ yếu vào bản chất của muối |
| Phản ứng SN1 nhanh hơn đáng kể trong dung môi protic | Phản ứng SN1 chậm trong dung môi aprotic (không proton) |
| Phản ứng SN2 rất chậm trong dung môi protic | Phản ứng SN2 nhanh hơn đáng kể trong dung môi aprotic (không proton) |
| Dung môi protic phân cực ổn định cacbocation và nucleophile | Dung môi không proton phân cực không thể liên kết hydro với nucleophile |
| Nước, rượu, axit formic, hydro florua, amoniac, axit axetic, etanol, metanol, v.v. đều là dung môi protic | Acetone, dimethyl sulfoxide, HMF (hydroxymethylfurfural), ete vương miện, DMF (N,N-dimethylformamide), acetonitril, v.v. đều là dung môi không proton |
| Dung môi phân cực tạo ra khí hydro khi khử và do đó rất hữu ích trong điện hóa khử | Dung môi tạp chất được sử dụng trong nhiều ngành công nghiệp bao gồm nhưng không giới hạn ở dầu khí, sơn và chất phủ, điện tử và dược phẩm |
Điểm tương đồng giữa dung môi protic và aprotic
- Cả dung môi protic và aprotic đều là dung môi phân cực.
- Cả hai đều có thể hòa tan muối.
Dung môi protic là gì?
Nói chung, bất kỳ dung môi nào có H + không bền đều là dung môi protic. Proton này luôn sẵn sàng cho các chất hòa tan, thường được cung cấp thông qua liên kết hydro. Nước là dung môi protic phổ biến nhất.
(Các) nguyên tử hydro thường liên kết với một nguyên tử oxy, như trong nhóm hydroxyl, một nguyên tử nitơ, như trong nhóm amin, và florua, như trong hydro florua. Đây là những ví dụ về dung môi protic phân cực: Nước (H 2 O), axit fomic (CH 2 O 2 ), hydro florua (HF), etanol (C 2 H 5 OH), amoniac (NH 3 ), metanol (CH 3 OH), axit axetic (CH 3 COOH ), vân vân.
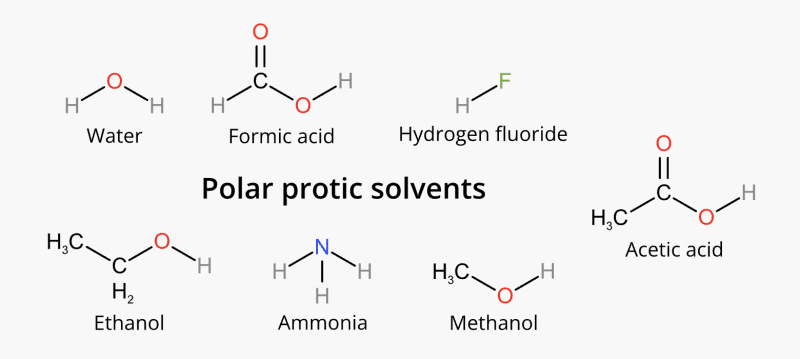
Dung môi aprotic là gì?
Dung môi tạp chất thiếu proton axit. Do đó, chúng không thể đóng vai trò là chất cho proton trong liên kết hydro. Không giống như các dung môi phân cực, chúng thiếu các nhóm hydroxyl và amin.
Các dung môi không proton phân cực được quan tâm đặc biệt vì khả năng hòa tan muối của chúng, mặc dù chúng không thể tặng proton. Nhiều hydrocacbon và clorocacbon được phân loại là dung môi không proton.
Một số ví dụ về dung môi không proton là axeton (H 3 C-(C=O)-CH 3 ), Etyl axetat, DMSO, dimetyl sulphoxit ((CH 3 ) 2 S=O), DMF, N,N-dimetylformamit (C 3 H 7 NO), HMF (hydroxymethylfurfural), Oxolane/tetrahydrofuran (THF), ete vương miện và axetonitril (CH 3 C≡N), v.v.
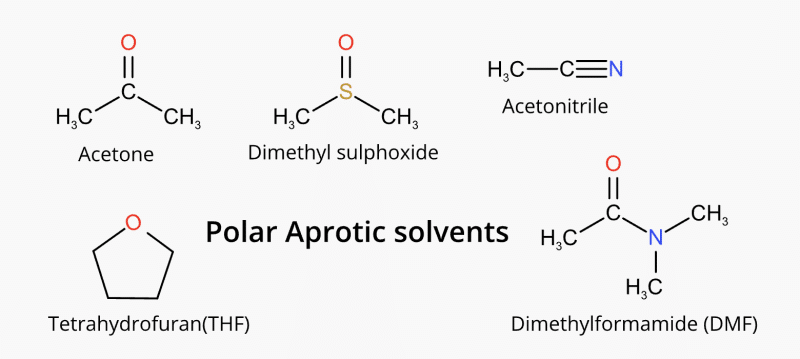
Ảnh hưởng của dung môi protic và aprotic đối với sự thay thế nucleophilic
Trong dung môi protic, các anion bị hòa tan do có liên kết hydro, do đó, khả năng hoạt động như một nucleophile của chúng được tạo ra. Mặt khác, các anion không bị hòa tan và sẽ không ảnh hưởng đến tốc độ phản ứng trong dung môi không proton.
Nói chung, những kết luận này có thể được rút ra từ tuyên bố trên:
-
- Tất cả các nucleophile có xu hướng phản ứng mạnh hơn trong dung môi không proton so với dung môi protic.
- Các loài được hòa tan mạnh trong dung môi protic phân cực sẽ thu được khả năng phản ứng trong dung môi không proton phân cực, ví dụ như F – , v.v.
- Dung môi aprotic (không proton) phân cực thường được sử dụng khi dung môi protic phân cực cho kết quả kém do các nucleophile yếu như F – , -CN, RCO 2 – , v.v.
Phản ứng S N 1 và S N 2
Cả dung môi protic và aprotic có ảnh hưởng khác nhau đến tốc độ của các phản ứng S N 1 và S N 2 . Trong các phản ứng đó, việc sử dụng dung môi protic phân cực thuận lợi cho cơ chế phản ứng S N 1 , trong khi dung môi không proton phân cực thuận lợi cho cơ chế phản ứng S N 2.
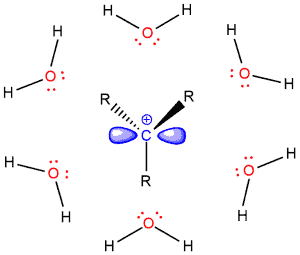
Phản ứng S N 1 hoạt động tốt đối với alkyl halogenua bậc ba vì sự mất nhóm rời tạo thành cacbocation bậc ba, đây là dạng cacbocation bền nhất. Một dung môi protic phân cực sẽ ổn định carbocation này.
Nhưng các phản ứng S N 2 không hoạt động tốt trong các dung môi protic phân cực vì các dung môi này làm yếu nucleophile làm cho nó ít nucleophile hơn. Điều này có thể được giải thích bằng trường hợp florua hoặc iodua trong môi trường protic, ví dụ như trong rượu (ROH). Điện tích âm của ion florua được ổn định bởi điện tích dương một phần của hydro.
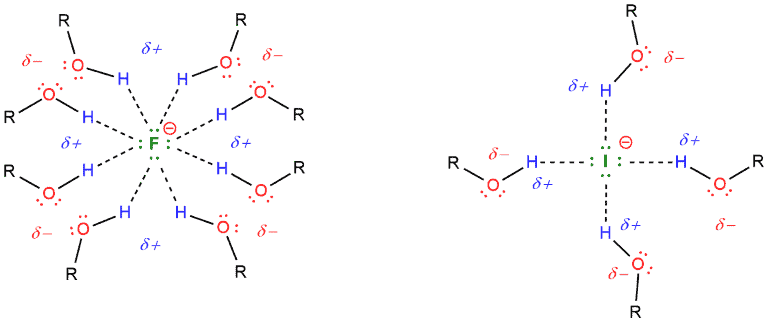
Các dung môi không proton phân cực hoạt động rất tốt cho các phản ứng S N 2 vì chúng không hòa tan các nucleophile. Ví dụ, nếu chúng ta có kali florua và ete vương miện làm dung môi, thì ete này sẽ hòa tan kali chứ không phải florua. Sau đó, florua sẽ tự do tham gia phản ứng với chất nền .
Ảnh hưởng của dung môi không proton phân cực đến tốc độ phản ứng S N 2 là đáng kể. Tốc độ của phản ứng này phụ thuộc nhiều vào việc lựa chọn dung môi. Phản ứng S N 2 trong dung môi không proton phân cực nhanh hơn đáng kể so với trong dung môi protic.
Khái niệm Berg
Protic nghĩa là gì?
Từ protic có nghĩa là “dung môi hoặc môi trường lỏng khác, có thể cung cấp các nguyên tử hydro cho quá trình proton hóa”.
Tại sao axeton được coi là dung môi không proton phân cực?
Acetone là một dung môi không proton phân cực vì nó không có bất kỳ nguyên tử hydro nào được gắn trực tiếp vào nguyên tử có độ âm điện (O).
Dimethyl sulfoxide là protic hay aprotic?
Dimethyl sulfoxide (DMSO), CH 3 SOCH 3 là dung môi không proton có cực vì nó không chứa proton liên kết trực tiếp với nguyên tử có độ âm điện nhưng vẫn có cực.
Tại sao dung môi không proton tốt hơn cho phản ứng S N 2?
Trong dung môi không proton, nucleophile hầu như không bị hoà tan nên chúng tấn công cơ chất dễ dàng hơn. Do đó, các phản ứng SN2 được ưu tiên trong môi trường không proton, vì có ít cản trở hơn đối với các nucleophile. Trong môi trường protic, nucleophile bị mắc kẹt trong lồng các phân tử dung môi và do đó trở nên không hoạt động.
Benzen có phải là dung môi protic không?
Benzen là một dung môi không phân cực được sử dụng để sản xuất một số lượng lớn hóa chất.
Methanol có phải là dung môi protic không?
Đúng. Methanol là dung môi protic phân cực do có (OH) phản ứng.
Ethanol là protic hay aprotic?
Cồn Ethanol là một dung môi protic phân cực vì có sự hiện diện của liên kết (OH).
Làm cách nào để xác định xem một dung môi là aprotic phân cực hay dung môi protic?
Dung môi protic có liên kết OH và NH và chúng có thể tạo thành liên kết hydro. Dung môi tạp chất có thể có các nguyên tử hydro ở đâu đó, nhưng chúng không được liên kết trực tiếp với O hoặc N (thiếu liên kết OH hoặc NH) và do đó không thể tạo liên kết hydro.
Tại sao NaOH thể hiện cường độ cơ bản cao nhất trong dung môi protic phân cực?
Bản thân NaOH là một bazơ tốt. Trong dung môi protic, các liên kết OH và NH có mặt đóng vai trò là chất cho proton và hình thành liên kết hydro mạnh. Điều này dẫn đến sự phân ly ngay lập tức của NaOH thành các ion cấu thành của nó (Na + và OH – ). NaOH giải phóng ion OH– nhanh chóng và do đó, nó thể hiện sức mạnh tối đa trong dung môi protic phân cực.



