Liên kết cộng hoá trị phân cực là một phần của liên kết cộng hóa trị. Chúng ta cũng có thể nói rằng đó là ranh giới phân chia giữa sự hình thành liên kết cộng hóa trị thuần túy và liên kết ion.
Tuy nhiên, nếu chúng ta muốn định nghĩa chính xác hơn thì liên kết cộng hóa trị phân cực là liên kết tồn tại giữa hai nguyên tử gồm các electron phân bố không đều. Do trạng thái này, các phân tử có xu hướng có một số momen lưỡng cực điện trong đó hai đầu hoặc hơi dương hoặc hơi âm.
Liên kết cộng hoá trị phân cực
Định nghĩa: Liên kết cộng hoá trị phân cực là một loại liên kết cộng hóa trị trong đó các electron liên kết được phân bố không đều giữa các nguyên tử liên kết.
Sơ đồ sau đây cho thấy một phân tử hydro clorua. Hình ảnh cho thấy mật độ liên kết eletron (đám mây màu) tập trung xung quanh nguyên tử clo có độ âm điện lớn hơn.
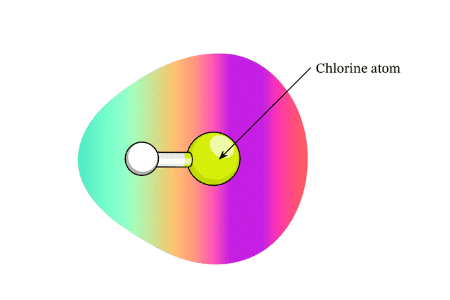
Liên kết cộng hóa trị có cực thường được hình thành giữa hai nguyên tử phi kim có độ âm điện khác nhau. Trong một liên kết cộng hoá trị phân cực:
- Các phân tử phân cực có sự phân bố mật độ electron không đối xứng vì một trong các nguyên tử liên kết cộng hóa trị có giá trị độ âm điện cao hơn nguyên tử kia.
- Độ âm điện đo lường xu hướng của một nguyên tử thu hút một cặp electron liên kết từ một liên kết hóa học.
Tính chất của các hợp chất có liên kết cộng hóa trị phân cực
- Trạng thái vật lý: Các hợp chất này có thể tồn tại dưới dạng chất rắn do lực tương tác lớn hơn.
- Điểm nóng chảy và sôi: Chúng có điểm nóng chảy và sôi lớn hơn các hợp chất không phân cực.
- Tính dẫn điện: Chúng dẫn điện ở trạng thái dung dịch do tính linh động của các ion.
- Độ hòa tan: Chúng hòa tan cao trong dung môi phân cực như nước.
Cách xác định liên kết cộng hoá trị phân cực, không phân cực và liên kết ion
Độ âm điện đóng vai trò chính trong việc xác định các loại liên kết cộng hóa trị và liên kết ion. Độ âm điện là xu hướng của một nguyên tử thu hút một cặp electron dùng chung về phía chính nó. Nó không có đơn vị đơn giản nó là một xu hướng.
Năm 1932, Linus Pauling nổi tiếng giới thiệu thang đo độ âm điện chính xác có thể được sử dụng để định lượng khả năng của bất kỳ nguyên tố nào rút mật độ electron từ các cặp electron liên kết.
- Các nguyên tố thường sẽ liên kết với nhau và tạo ra các liên kết cộng hóa trị không phân cực khi chênh lệch giá trị độ âm điện (hiệu độ âm điện) của chúng nhỏ hơn 0,4.
- Các nguyên tố thường liên kết với nhau và tạo thành liên kết cộng hóa trị phân cực khi hiệu độ âm điện lớn hơn 0,4 và nhỏ hơn 1,7.
- Các nguyên tố thường liên kết với nhau và tạo thành nhiều liên kết ion hơn khi hiệu độ âm điện lớn hơn 1,7
Bảng tóm tắt cách xác định liên kết cộng hoá trị phân cực và không phân cực và liên kết ion:
| Loại liên kết | Độ âm điện chênh lệch | Ví dụ phân tử |
|---|---|---|
| Cộng hóa trị thuần tuý | 0 | Khí hydro ( )H2 |
| Cộng hóa trị không cực | Ít hơn 0,4 | Mêtan ( )CH4 |
| Cực trị | Giữa 0,4 và 1,7 | Hydro florua ( )HF |
| ion | Lớn hơn 1,7 | Natri florua ( )NaF |
Các giá trị độ âm điện Pauling có thể được sử dụng để hiểu tại sao một số nguyên tử tạo thành các hợp chất phân tử đơn giản, trong khi các nguyên tử khác liên kết với nhau và tạo thành mạng ion khổng lồ.
Các nguyên tố thường sẽ liên kết với nhau và tạo thành các hợp chất liên kết cộng hóa trị đơn giản khi chúng có cùng giá trị độ âm điện giống nhau hoặc rất giống nhau. Các nguyên tố thường sẽ liên kết ion và tạo thành các cấu trúc ion khổng lồ khi một trong các nguyên tố có giá trị độ âm điện rất thấp và nguyên tố kia có giá trị độ âm điện cao hơn nhiều.
Mômen lưỡng cực
Sự phân cực của liên kết cộng hóa trị cũng có thể được giải thích bằng một đại lượng vật lý gọi là momen lưỡng cực (μ).
Mô men lưỡng cực được định nghĩa là tích của điện tích và khoảng cách phân tách điện tích. Khoảnh khắc lưỡng cực được ký hiệu là ‘μ‘ và đơn vị của nó là Debye (hoặc) esu cm.
μ = 𝛿 . d
Trong đó:
- μ là mô men lưỡng cực liên kết;
- 𝛿 là độ lớn của các điện tích riêng 𝛿 + và 𝛿 – ;
- Và d là khoảng cách giữa 𝛿 + và 𝛿 – .
Các phân tử thường sẽ không có momen lưỡng cực tổng thể nếu chúng có hình dạng đối xứng cao. Do đó, chúng sẽ không có lưỡng cực ngay cả khi được hình thành bởi các liên kết có cực. Những hình học này bao gồm tuyến tính, hình phẳng tam giác, tứ diện, bát diện và bipyramid tam giác.
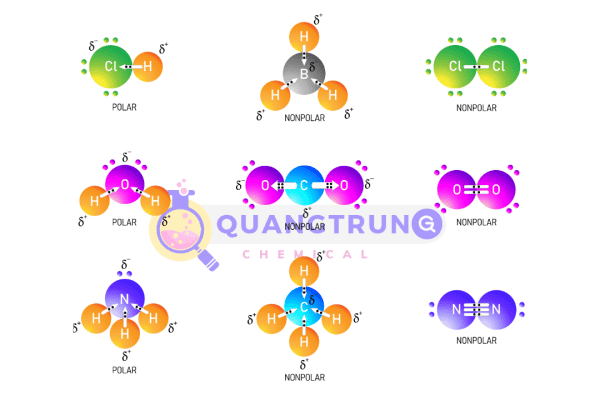
Nguồn tham khảo: Polar Covalent Bond Principles of Organic Chemistry, 2015



