Bạn có thể điều chế ethyl acetate như thế nào? ethyl acetate có thể được tổng hợp theo nhiều cách khác nhau. Đây là quá trình tổng hợp ethyl acetate sử dụng cồn ethanol và natri cacbonat.
Các phương pháp điều chế ethyl acetate
Ethyl Acetate là một este của acid acetic và ethanol, có công thức hóa học [CH3COOCH2CH3]. Nó là một hợp chất không màu với mùi ngọt ngào và trái cây. Nó là một hợp chất dễ bay hơi. Nó là este thường được tìm thấy nhiều nhất trong trái cây.
Acid acetic hoặc axit ethanoic là một axit cacboxylic và là thành phần của giấm. Công thức hóa học của acid acetic là [CH3COOH].
Để điều chế ethyl acetate, bạn có thể sử dụng các phương pháp sau;
1. Phương pháp chưng cất
Như chúng ta đã biết, Ethyl Acetate là một este. Để điều chế Ethyl Acetate từ acid acetic, cần tiến hành este hóa acid acetic.
Khi acid acetic phản ứng với ethanol với sự có mặt của axit sunfuric, Ethyl Acetate được tạo ra thông qua quá trình este hóa. Quá trình este hóa là phản ứng hóa học giữa axit cacboxylic và rượu để tạo ra este.
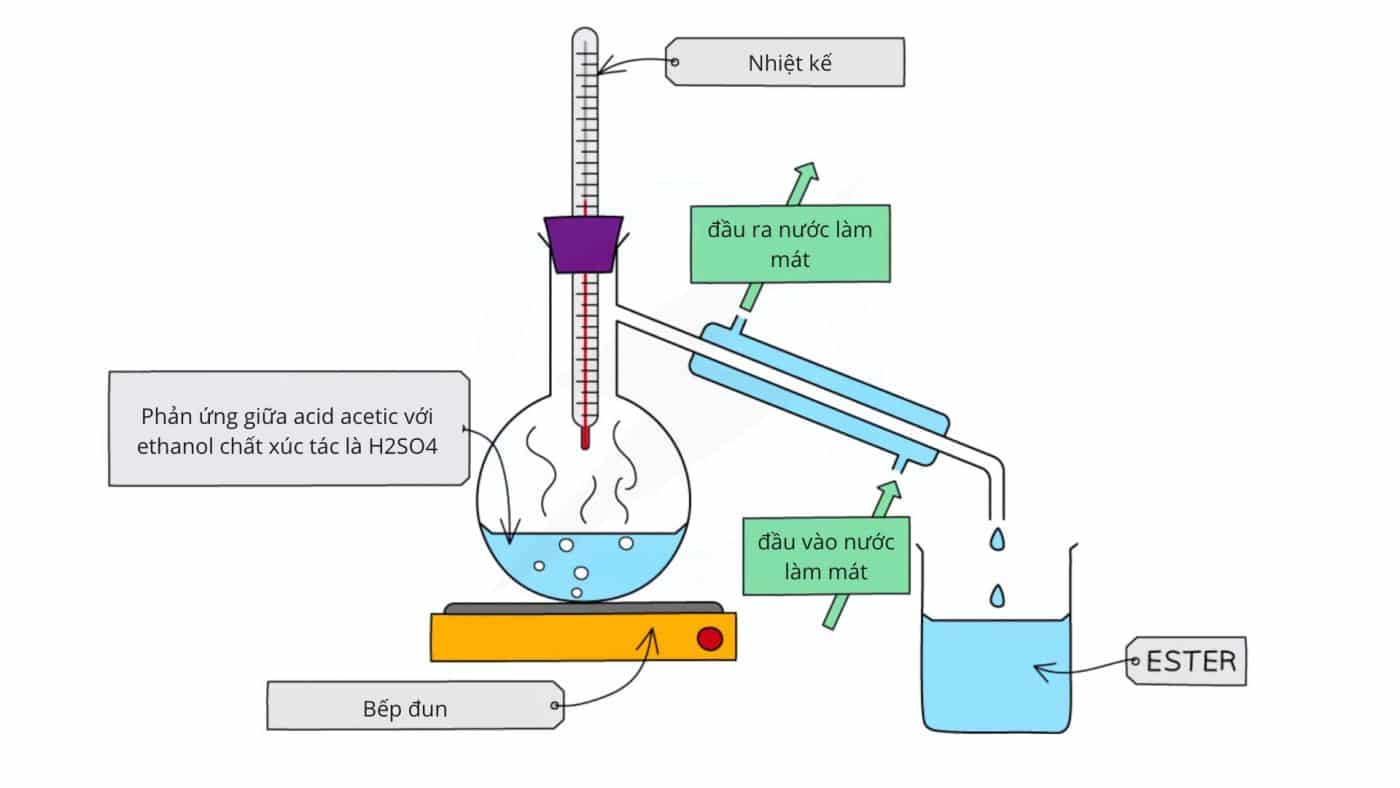
Trong phản ứng hóa học này, H2SO4 đóng vai trò là chất khử nước và khử các phân tử nước để tạo ra este. Quá trình este hóa là một phản ứng thuận nghịch và là một quá trình khá chậm. H2SO4 cũng đóng vai trò là chất xúc tác trong phản ứng này. Phản ứng hóa học để tạo thành Ethyl Acetate từ acid acetic được trình bày dưới đây.
CH3COOH+CH3CH2OH⇌CH3COOCH3CH2+H2O
Phản ứng được thực hiện bằng cách đun nóng các chất phản ứng với sự có mặt của H2SO4.
Bước cuối cùng là tinh chế thêm để loại bỏ tạp chất.
- Để loại bỏ các tạp chất có tính axit, có thể thêm dung dịch natri cacbonat, cho đến khi hỗn hợp ngừng sủi bọt (không còn khí cacbonic thoát ra nữa)
- Để loại bỏ ethanol có thể thêm dung dịch canxi clorua.
Lưu ý:
Phản ứng este hóa liên quan đến việc kết hợp axit cacboxylic và rượu với sự có mặt của H2SO4 để thu được este. Hãy nhớ rằng rượu được đề cập ở đây phải là rượu chính.
Quá trình este hóa cũng có thể diễn ra bằng phản ứng của anhydrit axit với rượu hoặc phản ứng giữa axit clorua với rượu. Ở đây, rượu được đề cập là rượu chính.
Phương pháp này có thể được coi là một trong những phương pháp tốt nhất, vì nó thân thiện với môi trường và là một quy trình tương đối rẻ tiền.
2. Phương pháp oxy hóa
Trong phương pháp này, bạn có thể sử dụng hỗn hợp ethanol nguyên chất hoặc ethanol-nước với các tỷ lệ khác nhau của mỗi loại. Hỗn hợp này được hydro hóa và sau đó được hồi lưu với natri hypoclorit để xúc tác phản ứng oxy hóa ethanol thành axetaldehyt. Axit axetic được tạo ra bằng cách axit hóa hỗn hợp này và sau đó nó lại bị oxy hóa bằng khí oxy để điều chế ethyl acetate.
Có rất nhiều lợi thế khi sử dụng phương pháp này. Một là sự sẵn có của ethanol và chi phí tương đối thấp của nó. Nó cũng tạo ra một lượng ethyl acetate có thể quản lý được, có thể được sử dụng cho nhiều mục đích khác nhau.
3. Phương pháp lên men
Trong phương pháp này, men được sử dụng để sản xuất cồn ethanol và sản phẩm phụ là ethyl acetate. Một lợi thế của việc sử dụng men trong quy trình này là nó cung cấp một số lượng lớn các tùy chọn lên men và tiết kiệm tiền, vì một mẻ duy nhất có thể mang lại năng suất cao hơn các phương pháp khác.
Men có khả năng chuyển đổi đường thành rượu và carbon dioxide. Tuy nhiên, nó không thực sự tạo ra sản phẩm phụ là ethyl acetate. Lượng ethyl acetate phụ thuộc vào loại men được sử dụng cũng như loại và lượng đường được thêm vào và các điều kiện nuôi cấy khác. Điều này cho thấy bạn sẽ điều chế ethyl acetate như thế nào.
An toàn khi sử dụng ethyl acetate
1. Luôn đeo kính bảo hộ
Công nhân hoặc các sinh viên, các nhà thí nghiệm hoá học cần đeo kính bảo hộ khi xử lý hoặc tổng hợp ethyl acetate.
Chất này cực kỳ dễ cháy và có thể gây bỏng da và mắt. Sản phẩm có khả năng biến thành khí nổ ở phạm vi nhiệt độ và áp suất cao hơn. Nó dễ cháy và có thể bắt lửa dễ dàng, vì vậy phải cẩn thận khi cất giữ.
2. Các dụng cụ, thiết bị cần thiết khi làm việc với ethyl acetate.
Luôn sử dụng các thiết bị và dụng cụ an toàn thích hợp, chẳng hạn như tủ hút và hệ thống thông gió để tránh tiếp xúc với khói độc.
3. Sử dụng đúng đồ đựng khi bảo quản ethyl acetate.
Bảo quản ở nơi thông thoáng để tránh bị nhiễm bẩn và theo thời gian có thể trở nên nguy hiểm cho sức khỏe nếu không được xử lý đúng cách.
Chất này gây kích ứng và có hại cho sức khỏe, vì vậy hãy tránh cất giữ chất này gần hoặc xung quanh các sản phẩm thực phẩm hoặc chất lỏng có thể bị ảnh hưởng bởi tác động của nó đối với con người.
4. Đảm bảo rằng bạn có thiết bị phù hợp khi vận chuyển ethyl acetate.
Chất này phải được đóng gói trong các vật chứa cứng tương thích với hóa chất và cũng được dán nhãn phù hợp để vận chuyển an toàn nhằm tránh tai nạn và sử dụng ethyl acetate không đúng cách.
Xử lý ethyl acetate cẩn thận khi sử dụng nó cho các phản ứng hóa học hoặc tổng hợp, vì đây là một hợp chất rất dễ cháy. Khi vận chuyển nó đến các phòng thí nghiệm khác hoặc những nơi nó được sử dụng, hãy đảm bảo rằng các thùng chứa được dán nhãn đúng cách để tránh dán nhãn sai hoặc nhiễm bẩn bởi các hóa chất khác có thể dẫn đến cháy nổ.
5. Tuân thủ tất cả các biện pháp phòng ngừa an toàn
Báo cáo bất kỳ tai nạn nào liên quan đến chất này cho người giám sát của bạn ngay lập tức.
Tuân thủ tất cả các biện pháp phòng ngừa an toàn, mặc thiết bị bảo hộ và chỉ sử dụng các hóa chất được phê duyệt chính thức cho mục đích phòng thí nghiệm, theo hướng dẫn của giáo sư của bạn. Làm việc trong phòng thông gió tốt khi sử dụng hoặc điều chế ethyl acetate. Luôn để bình chữa cháy gần đó trong quá trình thí nghiệm để chuẩn bị sẵn sàng trong trường hợp có sự cố xảy ra.
Tóm lại, bạn sẽ điều chế ethyl acetate như thế nào, bạn có thể sử dụng phương pháp chưng cất, phương pháp oxy hóa, phương pháp lên men hoặc bất kỳ phương pháp nào khác thay thế để sản xuất ethyl acetate. Có nhiều mẹo và thủ thuật giúp quá trình này dễ dàng hơn nếu bạn không có kỹ năng về hóa học, vì vậy bạn có thể làm tốt hơn hầu hết các phương pháp này.
Nguồn: Bài viết được tổng hợp và biên soạn dựa trên các các định nghĩa và khái niệm về acid acetic từ wikipedia