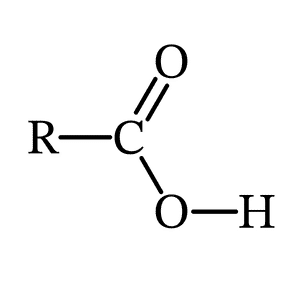
Tính chất của axit cacboxylic
Các Axit Cacboxylic đều là axit yếu. Trong dung dịch nước, liên kết O−H của nhóm hydroxyl có thể bị phá vỡ, tạo ra ion carboxylate âm và ion hydro.
Axit cacboxylic thể hiện liên kết hydro liên phân tử. Do đó, chúng có điểm sôi cao so với các chất khác có khối lượng phân tử tương đương.
Các liên kết hydro này không bị phá vỡ hoàn toàn ngay cả trong pha hơi. Vì vậy, chúng tồn tại dưới dạng Dimer (hoặc dime, chất nhị trùng) ở pha hơi hoặc trong dung môi không proton.
- Các phân tử axit cacboxylic có cực do sự hiện diện của hai nguyên tử oxy có độ âm điện.
- Chúng cũng tham gia vào liên kết hydro do sự có mặt của nhóm carbonyl (C=O) và nhóm hydroxyl.
- Khi được đặt trong dung môi không phân cực, các hợp chất này tạo thành dime thông qua liên kết hydro giữa nhóm hydroxyl của một axit cacboxylic và nhóm carbonyl của axit kia.
Bảng 1.1 Liệt kê một số tính chất vật lý cho các axit cacboxylic. Lưu ý rằng điểm sôi tăng khi tăng khối lượng phân tử, nhưng các điểm nóng chảy không có hình dạng thông thường.
| Công thức cấu tạo thu gọn | Tên axit cacboxylic | Điểm nóng chảy (°C) | Điểm sôi (°C) | Độ hòa tan (g/100 g nước) |
|---|---|---|---|---|
| HCOOH | axit formic | 8 | 100 | có thể trộn |
| CH3COOH _ _ | A-xít a-xê-tíc | 17 | 118 | có thể trộn |
| CH 3 CH 2 COOH | axit propionic | –22 | 141 | có thể trộn |
| CH 3 (CH 2 ) 2 COOH | axit butyric | –5 | 163 | có thể trộn |
| CH 3 (CH 2 ) 3 COOH | axit valeric | –35 | 187 | 5 |
| CH 3 (CH 2 ) 4 COOH | caproic acid | –3 | 205 | 1.1 |
| C6H5COOH _ _ _ _ | A xít benzoic | 122 | 249 | 0.29 |
Mùi đặc trưng của axit cacboxylic
Nhiều axit cacboxylic là chất lỏng không màu có mùi khó chịu. Chúng thường có mùi chua mạnh. Tuy nhiên, este của chúng có mùi dễ chịu và do đó được sử dụng trong nước hoa
Các axit cacboxylic có từ 5 đến 10 nguyên tử cacbon đều có mùi “dê” (giải thích mùi của phô mai Limburger). Các axit này cũng được tạo ra do tác động của vi khuẩn trên da đối với bã nhờn của con người (dầu trên da), là nguyên nhân gây ra mùi của các phòng thay đồ thông thoáng kém.
Các axit có hơn 10 nguyên tử cacbon là chất rắn giống như sáp và mùi của chúng giảm đi khi khối lượng phân tử tăng và kết quả là độ bay hơi giảm.
Tính axit của axit cacboxylic
Axit cacboxylic yếu hơn axit khoáng, nhưng mạnh hơn rượu và nhiều phenol đơn giản. Chúng là một trong những hợp chất hữu cơ có tính axit nhất.
Tính axit của axit cacboxylic cao hơn so với phenol là do bazơ liên hợp của axit cacboxylic (một ion cacboxylat), được ổn định bởi hai cấu trúc cộng hưởng tương đương.
- Bài viết chi tiết về: #3 Tính axit của axit cacboxylic
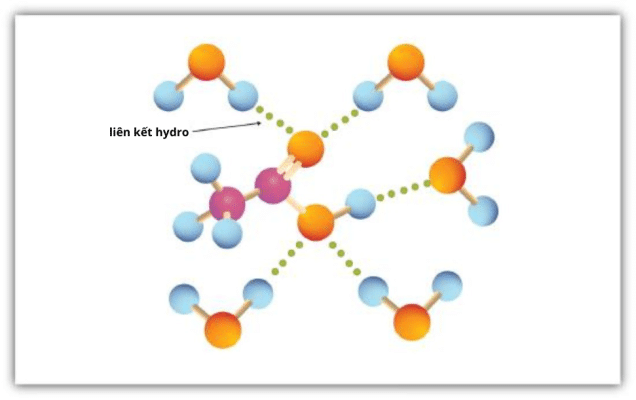
Nhóm cacboxyl dễ dàng tham gia tạo liên kết hydro với các phân tử nước (Hình 1.3). Các axit có một đến bốn nguyên tử carbon có thể trộn hoàn toàn với nước.
Độ hòa tan của axit cacboxylic
Khi số lượng nguyên tử carbon tăng lên, độ hòa tan của axit cacboxylic giảm.
Độ hoà tan của axit cacboxylic giảm khi chiều dài chuỗi carbon tăng lên vì lực lưỡng cực trở nên yếu dần và lực phân tán trở nên chiếm ưu thế hơn. (Cả 2 lực lưỡng cực và lực phân tán xảy ra trong liên kết nội phân tử. Xem phần: Lực Van der Waals)
Các axit cacboxylic béo đơn giản có tối đa bốn nguyên tử carbon (C-4) có thể trộn được trong nước do liên kết hydro với nước. Các thành phần cao hơn của axit cacboxylic không hòa tan trong nước do sự tương tác kỵ nước của phần hydrocacbon tăng lên.
Ví dụ:
- Bốn axit cacboxylic đầu tiên có nguồn gốc từ ankan là axit metanoic (HCOOH), axit ethanoic (CH 3 COOH), axit propanoic (C 2 H 5 COOH) và axit butanoic (C 3 H 7 COOH) tan hoàn toàn trong nước.
- Axit benzoic (axit cacboxylic thơm đơn giản nhất) gần như không tan trong nước lạnh.
- Axit hexanoic [CH 3 (CH 2 ) 4 COOH] hầu như không tan trong nước (khoảng 1,0 g/100 g nước).
- Axit palmitic [CH 3 (CH 2 ) 14 COOH], với thành phần hydrocacbon không phân cực lớn, về cơ bản không tan trong nước.
Các axit cacboxylic thường hòa tan trong các dung môi hữu cơ như etanol, toluen và dietyl ete.
Tóm tắt – Tính chất vật lý của axit cacboxylic
- Axit cacboxylic có thể hình thành liên kết hydro liên phân tử, do đó có điểm nóng chảy và điểm sôi tương đối cao so với các hợp chất hữu cơ khác không có liên kết hydro.
- Điểm sôi tăng theo khối lượng phân tử. Độ hòa tan giảm với khối lượng phân tử.
- Axit cacboxylic có mạch cacbon ngắn thì tan nhiều trong nước, còn axit có mạch cacbon dài thì tan ít hơn. Axit cacboxylic có một đến bốn nguyên tử carbon có thể trộn hoàn toàn với nước.
Bài tập tìm hiểu tính chất vật lý của axit cacboxylic
- So sánh nhiệt độ sôi của axit cacboxylic với rượu cùng loại khối lượng phân tử.?
- So sánh độ tan của axit cacboxylic trong nước với độ hòa tan của ankan và rượu tương đương trong nước.?