Tất cả về các nhóm chức năng
- Các nhóm chức năng là các nhóm nguyên tử cụ thể trong các phân tử có các tính chất đặc trưng riêng của chúng, bất kể các nguyên tử khác có trong phân tử.
- Các ví dụ phổ biến của các nhóm chức là rượu, anken, alkynes, amin, axit cacboxylic, andehit, xeton, este và ete, trong số những loại khác.
- Trong một khóa học hóa học hữu cơ điển hình của sinh viên năm thứ hai, có khoảng 15 nhóm chức năng chính, với một nhóm khác gồm 10 nhóm hoặc hơn để tạo nên sự xuất hiện nhất quán.
Nhóm chức năng là gì?
Nhóm chức năng là một nhóm các nguyên tử hoặc liên kết bên trong một chất chịu trách nhiệm cho các phản ứng hóa học độc đáo của chất đó trong hóa học hữu cơ. Bất kể hóa chất mà nó được tìm thấy, cùng một nhóm chức năng sẽ hoạt động tương tự và trải qua các phản ứng tương tự.
Do đó, có thể hiểu:
Nhóm chức năng là các gốc thể hiện những đặc điểm và tính chất riêng biệt của chúng không phụ thuộc vào phân tử mà chúng gắn vào.
Dưới đây là một số nhóm chức năng thường gặp nhất. Lưu ý rằng: ” R là phần giữ chỗ cho nhóm thế Cacbon chung.”
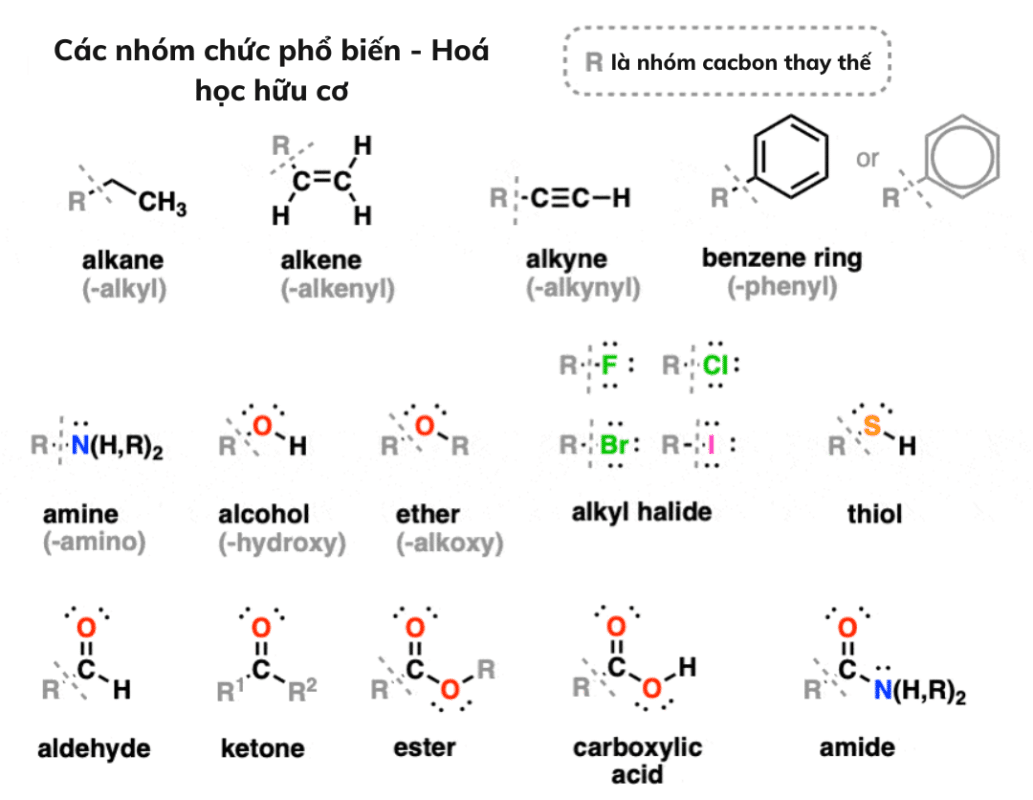
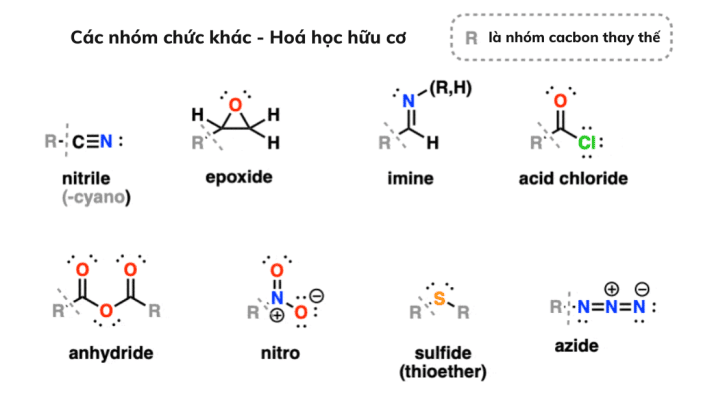
Một nhóm thứ hai của các nhóm chức năng ít gặp hơn một chút là ở đây. Đây không phải là một danh sách đầy đủ, nhưng ít nhất đó là một khởi đầu tốt.
Khi bắt đầu khóa học, việc được cung cấp một danh sách gồm 20-25 nhóm chức năng cần nhớ có vẻ như rất nhiều.Tin tốt là bạn đã học được rất nhiều tên nhóm chức năng mà không cần cố gắng quá nhiều.
Những cái tên này nghe có quen không?
Propane. Tylenol. Ibuprophen. Testosterone. Dopamine.
Học các nhóm chức năng sẽ là vấn đề kết nối các tên đó với các cấu trúc chung.
Một cách hay khác để biết các nhóm chức là nghĩ về độ âm điện tương đối của các nguyên tố trong mỗi nhóm. Điều đó sẽ giúp bạn hiểu các tính chất của chúng và giúp bạn suy nghĩ về cách chúng hoạt động trong các phản ứng hóa học.
Các nhóm chức năng phổ biến
Các nhóm chức phổ biến, cùng với tiền tố và hậu tố phải được sử dụng trong danh pháp của chúng được cung cấp trong tiểu mục này. Ngoài ra, một mô tả ngắn gọn về mỗi nhóm này cũng được cung cấp.
1. Ankan, anken, alkyn và các dẫn xuất của benzen
Ankan, anken, alkyn và các dẫn xuất của benzen được gọi là các nhóm hydrocarbyl vì chúng chỉ chứa các nguyên tử carbon và hydro. Tuy nhiên, chúng có thể khác nhau về các loại liên kết giữa hai nguyên tử carbon, chẳng hạn như liên kết đôi hoặc ba.
Các nhóm chức hydrocacbon rất không phân cực và có xu hướng là axit cực yếu.
Trong các nhóm chức hydrocacbon, các loại tương tác liên phân tử duy nhất là lực phân tán London. Và điểm sôi của chúng có xu hướng khá thấp, so với các phân tử chứa nhiều nhóm chức phân cực hơn.
Liên kết cộng hóa trị liên kết các nguyên tử của các nhóm này và toàn bộ nhóm với phân tử.
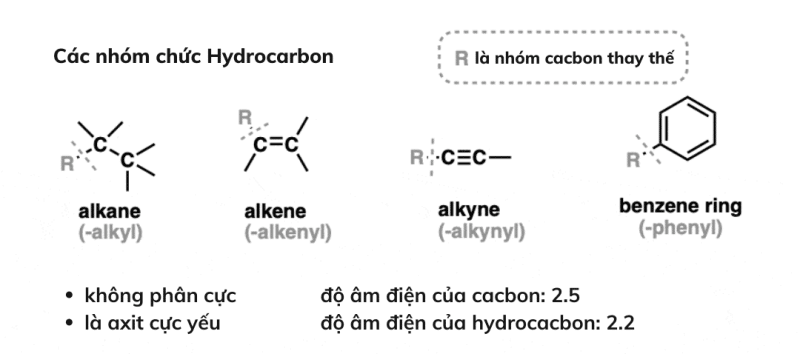
Ankan là hiđrocacbon không chứa liên kết bội. Nhóm thế ankan được gọi là nhóm alkyl, dùng để chỉ các ankan thiếu liên kết CH như metyl, etyl hoặc propyl.
- Các ví dụ phổ biến của ankan là metan, etan, propan, butan và octan.
- Liên kết CH có tính cộng hóa trị cao và ankan rất không phân cực. Chúng không trộn lẫn với nước.
- Các nguyên tử cacbon alkyl được lai hóa sp3 và có dạng hình học tứ diện về cacbon.
- Bạn thường có thể nghĩ về các nhóm alkyl như các nhóm chức năng “khán giả” của hóa học hữu cơ, viết tắt là R- . Chúng không tham gia phản ứng nhiều và khá trơ về mặt hoá học. Ngoại trừ sự thay thế gốc tự do (phản ứng thế halogen) và dĩ nhiên là sự đốt cháy, các ankan không trải qua một số lượng lớn các phản ứng khác nhau. Chúng có xu hướng cung cấp xương sống của hầu hết các phân tử hữu cơ.
Anken là những hiđrocacbon có một hay nhiều liên kết đôi cacbon-cacbon.
- Các ví dụ phổ biến là ethene, propene và butene.
- Nhóm thế anken được gọi là nhóm ankenyl, vinyl thường được dùng để chỉ -CH=CH 2 .
- Ankenyl cacbon ở trạng thái lai hóa sp2 , có dạng hình học phẳng lượng giác.
Alkynes chứa liên kết ba carbon-carbon.
- Ethyne ( axetylen ) là alkyne đơn giản nhất ; alkynes đôi khi được gọi là axetylen.
- Nhóm thế alkyne được gọi là nhóm alkynyl .
- Các alkynes đầu cuối có CH. Alkynes bên trong có liên kết CC ở mỗi đầu.
- Các nguyên tử cacbon alkynyl được lai hóa sp với dạng hình học tuyến tính.
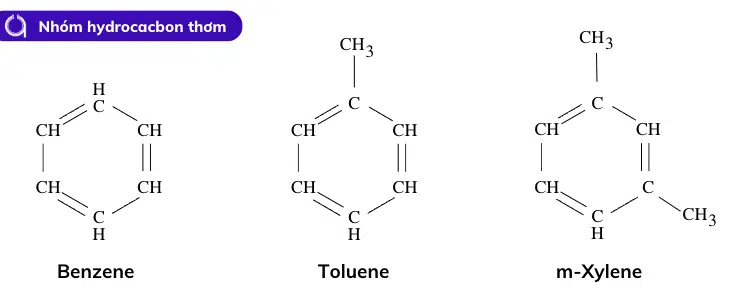
Vòng benzen là vòng sáu cạnh chứa 3 liên kết đôi. Các vòng benzen phổ biến trong tự nhiên do một đặc tính gọi là tính thơm (không liên quan gì đến mùi của nó) khiến chúng ổn định một cách bất thường. Cũng có thể được vẽ dưới dạng hình lục giác với hình tròn.
- Benzen, metylbenzen (toluen) là nguyên nhân tạo ra mùi của keo dán máy bay mô hình.
- Nhóm thế benzen C 6 H 5 –được gọi là nhóm phenyl.
- Các nguyên tử cacbon trong benzen ở trạng thái lai hóa sp2 với dạng hình học phẳng lượng giác.
Ví dụ về ankan, anken , ankin và hydrocacbon thơm.
2. Rượu, Ether, Amin, Thiol, Alkyl halogenua
Các nhóm chức năng này phân cực hơn đáng kể do sự khác biệt lớn hơn về độ âm điện giữa các nguyên tử liên kết.
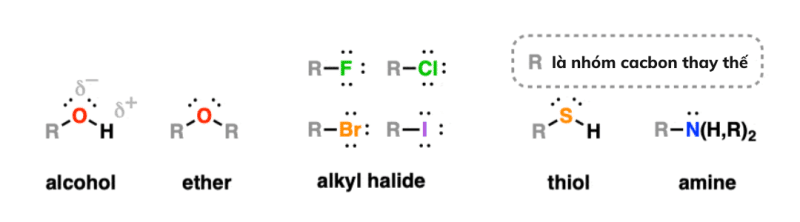
Rượu, Ether, Amin, Thiol, Alkyl halogenua có chứa nguyên tử carbon (độ âm điện của carbon là 2.5) liên kết với một nguyên tử có độ âm điện lớn hơn.

Vì vậy mỗi nhóm chức năng chứa một lưỡng cực trong đó carbon có một phần điện tích dương và nguyên tử đính kèm có một phần điện tích âm.
Ngoài ra, rượu và amin có khả năng đóng vai trò là chất cho liên kết hydro.
Các lực liên phân tử mạnh hơn có mặt trong các nhóm chức này do tương tác lưỡng cực-lưỡng cực. Ngoài ra, rượu và amin có khả năng liên kết hydro, làm tăng thêm điểm sôi.
Sự hiện diện của các nhóm chức trong một phân tử cũng ảnh hưởng đến độ hòa tan và xu hướng hình thành phức tạp của phân tử. Nếu các nhóm chức của chất tan và dung môi tương tác tốt, độ hòa tan tăng lên. Ví dụ, vì đường và nước đều chứa -OH ( nhóm hydroxyl ), đường có thể dễ dàng hòa tan trong nước.
Rượu R-OH chứa carbon liên kết với nhóm hydroxyl -OH.
- Các ví dụ phổ biến bao gồm metanol, metanol, isopropanol.
- Liên kết OH phân cực mạnh và tham gia tạo liên kết hiđro.
- Các nhóm hydroxyl cũng làm tăng khả năng hòa tan trong nước.
- Rượu là axit yếu và cũng có thể đóng vai trò là bazơ Lewis.
- Các nhóm hydroxyl liên kết với C=O được coi là axit cacboxylic, một nhóm chức năng riêng biệt (xem bên dưới)
Ethers ROR là các nguyên tử oxy có hai liên kết với carbon.
- Dietyl ete , tetrahydrofuran và dioxan là những ete thường được sử dụng làm dung môi trong phòng thí nghiệm.
- Ether không thể đóng vai trò là chất cho liên kết hydro, vì vậy điểm sôi của chúng thấp hơn điểm sôi của rượu có khối lượng phân tử tương đương, nhưng cao hơn điểm sôi của hydrocacbon do lực lưỡng cực-lưỡng cực lớn hơn.
Ankyl halogenua có nhóm chức RF, R-Cl, R-Br, RI trong đó R là nhóm alkyl .
- Bromobutane, methyl bromide và chloroform đều là những ví dụ về alkyl halogenua.
- Các tương tác lưỡng cực-lưỡng cực dẫn đến các điểm sôi cao hơn so với các ankan.
- Nếu R là anken thì chúng là ankenyl halogenua.
- Các nhóm chức năng rất quan trọng cho các phản ứng thay thế và loại bỏ.
Amin chứa nhóm chức -NH 2 , -NHR hoặc NR 2 trong đó R là một hiđrocacbon .
- Morph ine , code ine và coca ine chỉ là ba trong số nhiều phân tử nổi bật có chứa amin .
- Nhóm thế amin được gọi là nhóm amin .
- Các amin có liên kết NH có khả năng liên kết hydro, dẫn đến nhiệt độ sôi và khả năng hòa tan trong nước cao hơn.
- Cặp đơn độc trên nitơ có thể hoạt động như một bazơ.
Thiols (mercaptans) R-SH là họ hàng chứa lưu huỳnh của rượu.
- Nguyên tử lưu huỳnh gần như không có độ âm điện như oxy, vì vậy liên kết SH ít bị phân cực hơn.
- Thiols có thể hoạt động như axit yếu; axit mạnh hơn ancol.
- Thiols nổi tiếng nhất với mùi hôi thối nồng nặc; ethanethiol được thêm vào khí tự nhiên để tạo cho khí có mùi đặc trưng.
3. Anđehit, xeton, axit cacboxylic, este
Nhóm C=O được gọi là nhóm carbonyl. Liên kết C=O bị phân cực mạnh về phía oxy và carbon mang điện tích dương một phần.
Cacbonyl được tìm thấy trong andehit, xeton, este và axit cacboxylic.
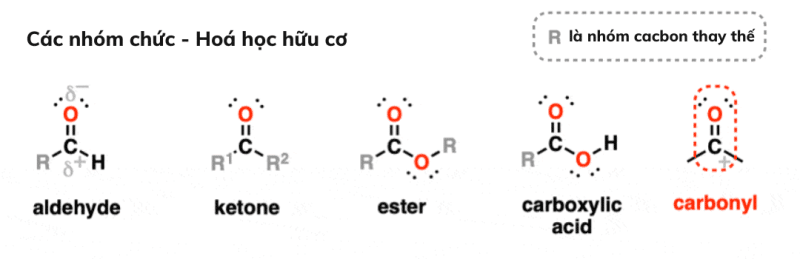
Mỗi nhóm chức này chứa mỗi nhóm Carbonyl – một carbon liên kết đôi với nguyên tử oxy có độ âm điện cao. Trong từng trường hợp Carbon chịu một phần điện tích dương và Nguyên tử Oxy chịu một phần điện tích âm.
Anđehit RCHO có liên kết C=O với cacbon và với CH
- Formaldehyd, acetaldehyde và benzaldehyde là những ví dụ phổ biến.
- Chúng có liên kết cộng hóa trị phân cực nhưng không phải là chất cho liên kết hydro
Ketone RC(O)R có C=O liên kết với hai nguyên tử cacbon.
- Acetone (2-propanone) là chất tẩy sơn móng tay.
Axit cacboxylic RCOOH có liên kết cacbonyl với -OH. Chúng là các nhóm chức riêng biệt với rượu.
- Axit axetic (giấm) và axit formic là những axit cacboxylic đơn giản nhất. Các axit chuỗi ngắn khác như butanoic và axit pentanoic nổi tiếng với mùi phòng thay đồ (hoặc tệ hơn).
- Nhóm hydroxyl tham gia vào liên kết hydro và kết quả là axit cacboxylic có nhiệt độ sôi cao hơn.
- Mặc dù có tên gọi như vậy nhưng axit cacboxylic có xu hướng là axit tương đối yếu, không phân ly hoàn toàn trong nước (so với các axit mạnh như HCl và H 2 SO 4 ).
Este RCOOR tương tự như axit cacboxylic, ngoại trừ liên kết OH được thay thế bằng liên kết OC.
- Este đáng chú ý vì mùi ngọt ngào của chúng
- Chứa liên kết phân cực, nhưng không tham gia liên kết hiđro.
4. Amit, axit halogenua, anhydrit, nitril
Trên thực tế, có khá nhiều nhóm chức năng quan trọng có chứa carbonyl . Tất cả các nhóm chức này đều được coi là có nguồn gốc từ axit cacboxylic, vì chúng có thể thu được bằng cách thay thế OH bằng các nhóm khác nhau. ( Thoạt nhìn, nitriles có thể không liên quan đến axit cacboxylic, nhưng chúng thực sự có thể được chuyển đổi thành amit thông qua quá trình khử nước.)
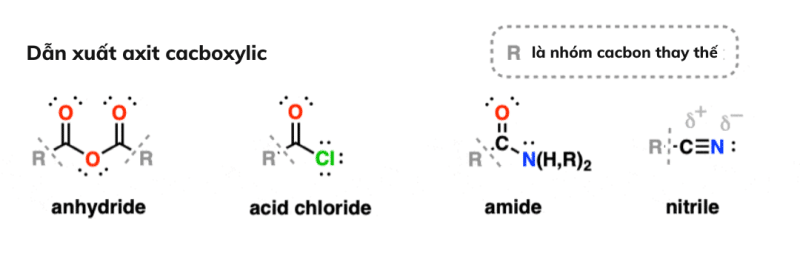
Các amit chứa một cacbonyl cacbon gắn với một nhóm amin.
- Các axit amin liên kết với nhau thông qua sự hình thành của một amit được gọi là peptit.
- Các amit chứa liên kết NH có thể tham gia liên kết hiđro.
Axit halogenua có -OH được thay thế bằng F, Cl, Br hoặc I.
Anhydrit chứa một oxy được bao quanh bởi hai carbonyl . Phân biệt với este .
- Anhydrit có thể được hình thành từ hai đương lượng của axit cacboxylic kèm theo sự mất H2O, do đó có tên như vậy.
Ban đầu, nitriles trông không giống như các dẫn xuất của axit cacboxylic , nhưng chúng có thể được hình thành thông qua quá trình khử nước của amit.
- Acetonitril là một dung môi phổ biến.
- “ Găng tay nitrile ” được làm từ cao su nitrile , một chất đồng trùng hợp của butadiene và acrylonitrile.
- Nhóm thế -CN đôi khi được gọi là xyanua.
- HCN, hydro xyanua, là một loại khí có độc tính cao. Ion xyanua (-)CN, thường được bắt gặp trong các khóa học giới thiệu (trên giấy, không phải trong phòng thí nghiệm!) và trải qua các phản ứng với alkyl halogenua.
Vẽ các ví dụ về amit, axit halogenua, anhydrit và nitrile .
Điền vào các nhóm chức năng của các phân tử nổi tiếng này.
6. Khác: Epoxit, Thioethers, Nitro, Imine, Azide
Một vài nhóm chức năng nổi bật đáng để biết khác như: Epoxit, Thioethers, Nitro, Imine, Azide.
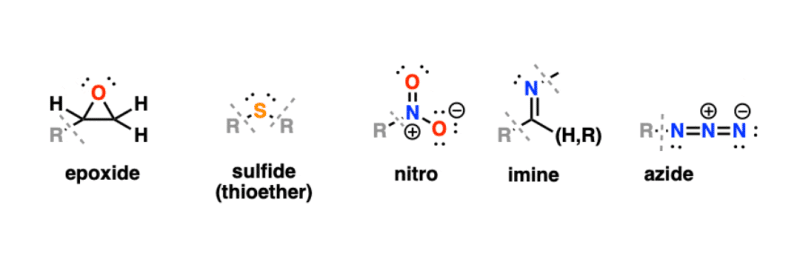
Về mặt kỹ thuật, Epoxit là ete, nhưng vì chúng tham gia vào một số phản ứng mà ete thường không có nên chúng xứng đáng được phân loại riêng.
Thioethers (sulfide) là chất lưu huỳnh tương đương với ete. Dimethyl sulfide là ví dụ thường gặp nhất.
Các nhóm nitro đang rút điện tử mạnh. Nitromethane, một dung môi, là ví dụ đơn giản nhất về nitroalkane.
Imin là các chất tương đương chứa nitơ của aldehyde và ketone.
Azides bật lên theo thời gian. Chữ “A” trong thuốc chống HIV AZT là viết tắt của azido.



